Краниофарингиома
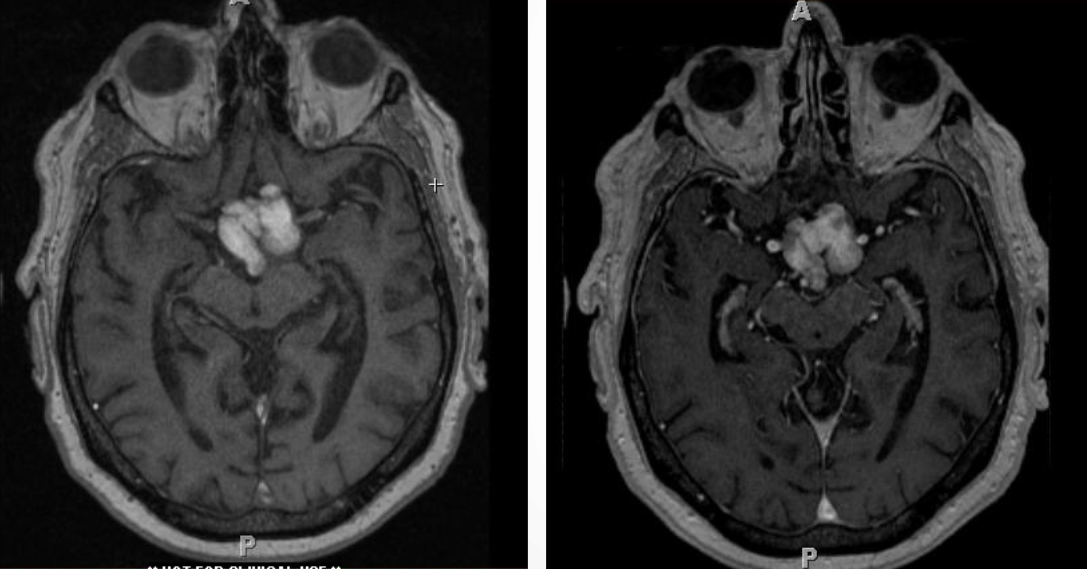
Краниофарингиома
Краниофарингиомы — эпителиальные опухоли, развивающиеся по ходу краниофарингеального канала они составляют 5,6—13% внутричерепных опухолей у детей.
Впервые была описана в 1857 году немецким патологом Фридрихом Альбертом фон Ценкером.
Краниофаренгиомы одни из самых сложных проблем для детских нейрохирургов из-за сложности их полного удаления и высокой частоты рецидивов из-за степени их инвазии в окружающие нервные и сосудистые структуры, такие как гипоталамус, гипофиз, зрительные пути и полигон Уиллиса. Опухоли имеют тенденцию рецидивировать даже после тотальной экстракции, но эта тенденция значительно возрастает при субтотальной экстракции. Тотальное удаление является основным методом лечения у отдельных пациентов, все больше литературы показывает, что визуальные, неврологические и эндокринные осложнения могут быть сведены к минимуму, в то время как аналогичные уровни контроля над опухолью могут быть достигнуты с помощью консервативных хирургических вмешательств с последующей вспомогательной фракционной или таргетной лучевой терапией.
ПАТОЛОГИЯ КРАНИОФАРИНГИОМЫ
Несмотря на свое селлярное расположение, кранофарингиомы представляют собой эпителиальные новообразования, а не глиальные или нейрональные поражения. Одонтогенные остатки, связанные с остатками мешка Ратке или остатки слизистой оболочки щеки (папиллярная КФО). Они почти всегда развиваются в селлярной/супраселлярной зоне. Также сообщалось, что КФО развивается в исключительных местах, таких как носоглотка, мостомозжечковый угол или внутри околоносовых пазух. Хотя имеется солидный компонент КФО, большинство из них сопровождается кистозным компонентом.
Как правило, более распространенные адамантиневматозные CFO у детей включают как солидные, так и кистозные поражения, в то время как менее распространенные папиллярные CFO у взрослых представляют собой солидные опухоли. Адамантиневматозные КФО макроскопически выглядят как дольчатая мягкая масса, обычно с кистозными пространствами. Пространства кисты содержат темно-коричнево-зеленую жидкость, которую иногда сравнивают с моторным маслом. Жидкость содержит липиды и поляризованные кристаллы холестерина. При световой микроскопии обнаруживаются отчетливые дольки эпителиальных клеток, такие как заметно расположенные периферические столбчатые эпителиальные клетки и более рыхлые массы эпителиальных клеток на периферии. Часто встречаются участки ороговения и кальцификации. Папиллярная краниофарингиома представляет собой солидную опухоль и состоит из слоев плоскоклеточных клеток. В связи с уникальным внешним видом КФО использование иммуногистохимических исследований не имеет значения.
ГЕНЕТИКА КРАНИОФАРИНГИОМЫ
Генетическая основа КФО недостаточно изучена. Обнаружение специфических биомаркеров в очагах с агрессивным течением может помочь стратифицировать пациентов, направить разработку методов лечения с поправкой на риск и новых методов лечения.
В ранних исследованиях было показано, что накопление β-катенина в ядре и аномальные паттерны экспрессии β-катенина могут быть обнаружены при адамантиневматозном KFO. Кроме того, мутации b-катенина были обнаружены в подмножестве KFO адамантиневматозного типа, но не в других типах опухолей гипофиза.
Хотя эти результаты предполагают, что патогенез педиатрических KFO может быть связан с аномалиями сигнала Wnt, их недостаточно для прогнозирования прогрессирования KFO. Интересно, что в смешанной серии KFO взрослых и детей низкие уровни рецептора ретиноевой кислоты b (RARb), галектина-3 и фактора ингибирования макрофагов (MIF) и высокие уровни рецептора ретиноевой кислоты g (RARg) были связаны с высоким риск рецидива. Было показано, что это может быть связано.
Роль этих белков в патогенезе КФО до сих пор неясна. Также была описана другая группа смешанных случаев, показывающая, что положительное иммуноокрашивание рецепторов эстрогена и прогестерона обратно пропорционально риску рецидива. Другие новаторские исследования не смогли выявить доказательств увеличения или потери в секвенировании ДНК (путем сравнительной генетической гибридизации и цитогенетического анализа).
ПРЕДОПЕРАЦИОННАЯ КЛИНИЧЕСКАЯ ОЦЕНКА
Классификация опухолей
Многие системы были разработаны для классификации этих опухолей и помощи в хирургическом планировании.
Хоффман и др. По расположению в турецком седле, перекресте зрительных нервов и Крыше III. Желудочка классифицировали опухоли как прехиазматические, ретрохиазматические, субхиазматические и внутрижелудочковые КФО в зависимости от их отношения к потолку желудочка.
С другой стороны, др Samii– сградуировали КФО в вертикальной проекции. I степень: интраселлярная или поддиафрагмальная, II степень: внутриселлярная часть присутствует/отсутствует, но она заполнила цистерну, III степень: III. нижняя половина желудочка, степень IV: III. верхний желудочек наполовину заполненный, Степень V: опухоль, достигшая прозрачной перегородки или боковых желудочков.
Радиологическая визуализация
Магнитно-резонансная томография (МРТ) превосходит компьютерную томографию (КТ) в оценке локализации и распространения опухоли при КФО.
Хотя КТ необходима для того, чтобы показать степень кальцификации и взаимосвязь опухоли с изменениями костной структуры в основании черепа, МРТ детально выявляет взаимосвязь опухоли с окружающими сосудисто-нервными структурами, вовлечение турецкого седла, желудочков и задней черепной ямки, соотношение между опухолью и перекрестом зрительных нервов, наличие кистозного компонента и гидроцефалии.
МР-ангиография может быть полезной для демонстрации взаимосвязи опухоли с окружающим сосудом и при планировании хирургического вмешательства
Эндокринологическая оценка
Эндокринная дисфункция распространеннео явление и возникает в результате сдавления опухолью гипоталамо-гипофизарной оси. Часто у детей могут возникнуть задержка роста или несахарный диабет и симптомы гипоталамуса.
Дефицит кортизола и гормонов щитовидной железы — это гормоны, которые могут оказывать сильное влияние на течение послеоперационного периода, и их следует оценить перед операцией и обеспечить соответствующие уровни в крови.
Гормон роста, инсулиноподобный фактор роста-1, сывороточный пролактин, фолликулостимулирующий гормон, лютеинизирующий гормон, тестостерон и эстрадиол у пациентов мужского и женского пола должны быть измерены для получения предоперационных пороговых значений.
Всем пациентам следует назначать ударную дозу экзогенных глюкокортикоидов из-за риска развития гипокортизолемии. Пероральное замещение гормонами щитовидной железы в идеале следует начинать за неделю до операции для поддержания эутиреоидного статуса. Внутривенную заместительную гормональную терапию следует использовать в экстренных случаях.
Офтальмологическое обследование
Нарушения зрения также распространены и являются результатом прямого сдавления зрительного тракта или высокого внутричерепного давления. У пациентов могут наблюдаться снижение остроты зрения, двоение в глазах, нечеткость зрения, битемпоральная гемианопсия, центральные скотомы, нистагм и слепота.
Необходимо проверить остроту зрения и поле зрения, а также провести оценку глазного дна для выявления отека диска зрительного нерва или атрофии зрительного нерва.
Хирургический подход
Первое успешное хирургическое удаление КФО было выполнено AE Halstead в 1909 г. с использованием интраназального пути, а в 1910 г. Dean Lewis сообщил о транскраниальном доступе для кистозных супраселлярных опухолей.
Harvey Cushing первоначально использовал транссфеноидальный доступ для этих поражений, но отошел от этого подхода из-за невозможности четко визуализировать область, сложности повторных операций и лучших результатов при TC.
Сегодня доступы транскраниальный или транссфеноидальный могут быть безопасно выполнены за счет лучшего выявления предоперационной хирургической анатомии с помощью рентгенологических исследований, таких как КТ и МРТ, развития микрохирургических методов и развития эндоскопических методов хирургии.
Идеальный рабочий угол для прехиазматического/субхиазматического/ ретрохиазматического расположения краниофарингиомы должен быть достигнут при сочетании каудо-краниального и срединного доступов.
Визуализация инфрахиазматической поверхности при краниокаудальных доступах неудовлетворительна, а при латеральных доступах требуется манипулирование нормальными нервно-сосудистыми структурами вокруг интересующей области.
Утверждается, что микроскопический или эндоскопический подходы к транссфеноидальному доступу или их комбинация позволяют хорошо визуализировать соответствующую инфрахиазматическую область без необходимости манипуляций с оптико-каротидной или окружающей цистерной для вмешательства на опухоли, и это единственный хирургический доступ, который сочетает в себе кауда- краниальный и срединный подходы.
Принципы диссекции и удаления опухоли при ТК или ТС в основном одинаковы: рассечение паутинной оболочки для сохранения сосудисто-нервных сосудов, постепенное удаление опухоли, тщательная микрохирургическая экстракапсулярная диссекция и сохранение сосудисто-нервных структур (табл. 1)
Сообщалось о более высокой частоте тотального удаления и меньшем количестве рецидивов после тотального удаления у пациентов, получавших транссфеноидальный (ТС) -подход, например: разница в общей частоте удаления показывает, что выбор случая важен для хирургического доступа при ТС с учетом анатомических особенностей.
Фальбуш и др. применили хирургический транссфеноидальный подход к 29% пациентов в серии из 168 детей и взрослых. По сравнению с хирургическим транскраниальным (TK) доступом TC, хирургический доступ TС приводит к более высокой общей частоте удаления (86% ~ 46%), большему улучшению зрения (73% ~ 67%), меньшей заболеваемости (8% ~ 13%) и более высокому функциональный исход сообщил о степени независимости (91% ~ 78%).
Тем не менее, было заявлено, что по крайней мере 60% опухолей, пролеченных методом TС, имеют размер менее 2 сантиметров и, как правило, значительно меньше, чем опухоли, пролеченные путем TК. Они также заявили, что турецкое седло увеличивается более чем в 90% случаев, при ТС, что указывает на интраселлярное происхождение опухоли.
Чакрабарти и др. проанализировали хирургический опыт TС и TК доступов у 86 пациентов с КФО. Хирургический доступ к TС был применен в 79% случаев, что привело к более высокой частоте удаления (90% ~ 61%), большему улучшению зрения (87% ~ 61%), меньшему количеству осложнений и более короткому пребыванию в стационаре (4.2). ~ 7,8 дней). Только 16% случаев, когда в их серии выполнялся ТК доступ, были полностью супраселлярными и 88% имели кистозное содержимое. С другой стороны, все случаи, в которых применялся ТК-доступ, были локализованы в супраселлярной области, а 44% имели кистозное содержимое.
Они отдавали предпочтение ТК (транскраниальному) -подходу при выраженных солидных, супраселлярных или срединно-латеральных опухолях.
Недавние исследования показали, что пациенты имеют лучший прогноз при TС подходе, трудно сравнивать хирургические серии с TК и TС доступом. Хирургические серии с ТК-доступом имеют большее количество пациентов и более длительные периоды наблюдения, поэтому их можно считать очень ценными и «золотым стандартом».
С другой стороны, серии с транссфеноидальный (ТС) -подходом проведены меньшему количеству пациентов, поэтому более короткий период наблюдения и более ограниченные данные по сравнению с TК-подходом. Однородность характеристик опухоли (размер, расположение, нейроваскулярная адгезия), хирургический опыт и агрессивность хирургического удаления являются ограничениями этого сравнения.
В то время как в исследованиях с использованием TС-подхода сообщалось об увеличении послеоперационного нарушения зрения от 0 до 7%, об этом сообщалось и в TC-подходе.
Сообщалось об улучшении зрения от 6 до 15%, а также об улучшении нарушений зрения от 68 до 93% при TС-подходе и от 25-75% при TК-подходе.
Эти различия показывают, что при TС подходе можно лучше визуализировать инфрахиазматическую область, определить оптические структуры и лучше защитить перфоранты, ведущие к этим структурам.
Что касается эндокринопатии, частота новых эндокринопатий при транскраниальных доступах составляет от 24 до 66% пангипопитуитаризма и 43-79% несахарного диабета.
При трансфенодиальном подходе сообщалось о 18-67% случаев пангипопитуиразма и 8-48% перманентного несахарного диабета.
Эти различия можно объяснить лучшей визуализацией воронки, ножки и верхней гипофизарной артерии
На основе новейших технологий и доброкачественной гистологии краниофарингиомы, во многих центрах детской нейрохирургии преобладает идея о том, что полное удаление КФО обеспечит полное выздоровление.
Однако из-за его тесной связи с гипоталамусом, гипофизом и оптическими путями, из-за тяжелой заболеваемости, которая возникает при повреждении этих структур при полнойрезекции опухоли, в качестве алтернативы предложено субтотальная или частичная резекция с последующим проведением лучевой или радиохирургии.
В дополнение к демонстрации того, что полное удаление не предотвращает рецидив, в некоторых исследованиях сообщалось о сходных показателях контроля заболевания при частичном удалении и послеоперационной лучевой терапии, как и при полном удалении без значительных осложнений.
Др. Choux сообщил, что опухоль повторно развивается в 19% после тотального удаления и примерно в 30% в результате применения дополнительной лучевой терапии к субтотальному удалению.
Хотя первый хирургический доступ, по-видимому, имеет наилучшие шансы на полное удаление и хирургический контроль заболевания, он составляет 17,6% после транскраниального доступа в случаях с тотальной экстракцией, после транссфенодального доступа повторно рецидивируют 8% опухолей.
Таблица I: Преимущества, недостатки и показания различных хирургических доступов в случаях краниофарингиомы
|
|
Преимущество |
Недостаток |
Индикация |
||||
|
Передняя срединная линия |
|
|
|
||||
|
Трансфеноидальный |
Низкий риск повреждения зрения |
Трудности у детей с непневматизированной пазухой; Высокий риск утечки спинномозговой жидкости |
Опухоли I и II степени |
||||
|
Субфронтальный |
Прямое фронтальное направление; В 3-й желудочек можно попасть через терминальную пластинку. |
Открытие лобной пазухи; могут быть сложности с префиксной хиазмой |
Опухоли III и IV степени |
||||
|
Переднелатеральный |
|
|
|
||||
|
Птериональный |
Доступ к супраселлярной цистерне, несмотря на хиазму |
Ограниченный контралатеральный оптико-сонный треугольник и контралатеральное ретрокаротидное пространство; III. задняя часть желудочка с этой стороны не видна из-за гипоталамуса |
Может использоваться при интраселлярных, супраселлярных, прехиазматических и ретрохиазматических опухолях. |
||||
|
Орбитозигоматический |
Более легкий доступ к заднему клиноиду, базилярному гребню и супраселлярной области и более удобное использование хирургических инструментов |
то же самое как при птериональном доступе |
Подобно птерионалу, особенно эффективен при опухолях с выраженным супраселлярным распространением. |
||||
|
Внутрижелудочковый |
|
|
|
||||
|
Транскаллозно-трансвентрикулярный |
За счет расширения отверстия Монро |
Травма от иссечения |
Внутрижелудочковые опухоли |
||||
|
Транскортикально-трансвентрикулярный |
Меньший риск ретракционной травмы по сравнению с транскаллозальным доступом |
Повреждение коры головного мозга и риск послеоперационных судорог увеличивается |
Крупные опухоли желудочков, распространяющиеся на дорсальную поверхность мозга |
||||
|
Trans-lamina-terminalis |
|
|
|
||||
|
Другие подходы |
|
|
|
||||
|
Транспетросальный |
Обеспечивает широкое обнажение ретрохиазмальных опухолей. |
Меньший передней перфорации чем при субфронтальном доступе |
Крупные ретрохиазматические опухоли |
||||
|
Комбинированные подходы |
|
|
|
||||
|
Подвисочно-транспетрозальный |
|
|
Ретрохиазматические односторонние опухоли, распространяющиеся вдоль ската к задней черепной ямке. |
||||
|
Птерионально-транскаллозальный |
|
|
Крупная краниофарингиома |
||||
|
Субфронтально-птериональный
|
Визуализация латеральных опухолей, особенно распространяющихся в сильвиеву щель |
|
|
||||
Можно сказать, что подход TС более эффективен в обеспечении контроля над опухолью, поскольку средний период наблюдения в серии TС указан как 5,5 года. При ТК-доступе могут быть слепые пятна при доступе сверху или сбоку (субфронтальный или птериональный доступ), Др.Чакрабати предположили, что низкая частота рецидивов при TС подходе может быть связана с меньшим размером и экстрапиальным расположением большинства опухолей.
ЛУЧЕВАЯ ТЕРАПИЯ
Причиной начала использования лучевой терапии была серьезная заболеваемость и смертность, имевшие место в период после радикальной резекции, когда было показано, что консервативная хирургия обеспечивает отличный местный контроль с комбинацией частичного хирургического удаления и лучевой терапии (ЛТ). Кроме того, сообщалось, что повторные операции, которые могут вызвать дополнительную заболеваемость и смертность, можно избежать при использовании ЛТ в период после частичного удаления КФО.
Аггарвал и др. в своем литературном обзоре, показывающем значительное превосходство (75–90–30–50%) в ретроспективных исследованиях с одной группой, сравнивающих 10-летний уровень контроля над опухолью только со случаями, в которых полное удаление не выполнялось (75–50%). 90 ~ 30- 50%), ЛТ использовалась в качестве стандартного лечения в случаях с остаточной или рецидивирующей КФО. Они пришли к выводу, что это приводит к приемлемости. Приведенные результаты в основном основаны на традиционной методике внешней ЛТ.
Тем не менее, в одном исследовании сообщалось, что 5-летний местный контроль над опухолью составляет более 90%, а 10-летний местный контроль составляет 100% при использовании более новых и высокоточных методов, таких как фракционированная стереотаксическая конформная лучевая терапия.
Нет проспективных рандомизированных исследований, сравнивающих различные подходы к лечению, чтобы обеспечить более высокий уровень доказательности выбора лечения. Сегодня, помимо традиционной лучевой терапии, могут применяться такие методики, фракционная стереотаксическая ЛТ, однофракционная радиохирургия (гамма-нож, кибер-нож) и протонная терапия.
ВНУТРИКИСТОЗНАЯ ТЕРАПИЯ
Радиоизотопы, такие как P32, Y90, Au198 и Re186, и внутрикистозные противоопухолевые препараты, такие как блеомицин, интерферон-а (IFNa), использовались для лучевой терапии (IBT) с внутрикистозными источниками бета-излучения с различной эффективностью и побочными эффектами при кистозной КФО.
Целями внутриполостной имплантации радиоизотопов или введения противоопухолевых препаратов являются уменьшение объема кисты опухоли и выполнение стереотаксической радиохирургии на оставшейся солидной части.
Идеальный выбор радиоизотопа является спорным. По сравнению с Y90, Р32 имеет значительно более длительный период полураспада (14,3 ~ 2,67 дня), имеет в 4,8 раза меньшую дозу (9,46 Гр ~ 45,8 Гр) и обладает более низкой энергией, показывает короткое проникновение в ткани (1,71 МэВ и 0,8 мм ~ 2,27 МэВ и 1,1 мм).
Таким образом, сообщается, что при использовании P32 окружающие здоровые ткани будут подвергаться более низкой дозе облучения. В исследовании, в котором IBT применяли с P32, Y90 или Re186, сообщалось, что зрение ухудшилось в 4 случаях, что привело к слепоте в 3 случаях, и в этих случаях Y90 использовался в качестве радиоизотопа.
Джулов и др. лечили 95 кист с помощью Y90 , сообщили о нейроофтальмологических осложнениях в 5,1% и осложнениях повреждения внутренней сонной артерии в 1,4%, и показали, что они достигли среднего уменьшения объема кисты на 74,7%.
Они заявили, что сокращение кисты началось через несколько месяцев после применения и завершилось через 6-12 месяцев. Кикингедер и др. сообщили, что они достигли контроля над кистами со скоростью 86 ± 5,3% за 5-летний период с P32 и что было ухудшение зрительных функций с прогрессированием опухоли со скоростью 9,8%
В дополнение к IBT, блеомицин и IFNa также использовались для внутрикистозного лечения КФО Частота начального ответа на блеомицин колеблется от 62% до 100%. Однако действие блеомицина кратковременно.
Хукин и др. сообщили, что среднее время без прогрессирования заболевания составляет всего 1,8 года. Кроме того, блеомицин обладает высокой нейротоксичностью. Серьезные осложнения, такие как потеря слуха, потеря зрения и диффузный отек головного мозга, были зарегистрированы примерно у 3% пациентов.
Кроме того, сообщалось о болезни моя-мойя, церебральной ишемии и дисфункции гипоталамуса.
Исследования IFNa немногочисленны. Кавальейро и др. опубликовали многоцентровое исследование с участием 60 пациентов. Они сообщили, что 78% контроль над опухолью был достигнут в среднем за 44 месяца наблюдения.
Авторы определили введение IFNα как простой в использовании, эффективный метод с небольшим количеством побочных эффектов (головная боль, отек, лихорадка и недомогание). Кроме того, о нейротоксических побочных эффектах IFNα не сообщалось. Следовательно, подтекание из кисты не является противопоказанием к лечению кистозной краниофарингиомы, в отличие от введения блеомицина или радиоизотопа.
ЗАКЛЮЧЕНИЕ
КФО представляют собой редкие эмбриональные пороки развития селлярной области с низкой степенью гистологической злокачественности. Несмотря на высокие показатели выживаемости, у долгоживущих пациентов качество жизни часто ухудшается из-за осложнений, вызванных анатомической близостью опухоли к зрительным путям, гипофизу и гипоталамусу.
Таким образом, наиболее подходящее лечение КФО является спорным.
Полное удаление связано с более низкой частотой рецидивов и более длительной выживаемостью, но это не всегда достигается без повреждения соседних критических структур и, следовательно, также может привести к осложнениям.
Полное удаление является лучшим шансом для пациентов, но если это невозможно, лечение следует сочетать с лучевой терапией. Расположение и характеристики опухоли должны помочь хирургу в выборе хирургического доступа. Кроме того, для лечения краниофарингиомы и ее осложнений у детей требуется мультидисциплинарный подход с участием детской нейрохирургии, а также эндокринологии, нейроофтальмологии и детской психиатрии.
Использованные источники
Aggarwal A, Fersht N, Brada M: Radiotherapy for craniopharyngioma. Pituitary 16:26-33, 2013
2. Barkhoudarian G, Laws ER: Craniopharyngioma: History. Pituitary 16:1-8, 2013
3. Bartels U, Laperriere N, Bouffet E, Drake J: Intracystic therapies for cystic craniopharyngioma in childhood. Front Endocrinol (Lausanne) 3:39, 2012
4. Beltran C, Roca M, Merchant TE: On the benefits and risks of proton therapy in pediatric craniopharyngioma. Int J Radiation Oncology Biol Phys 82(2):e281-e287, 2012
5. Buslei R, Nolde M, Hofmann B, et al: Common mutations of beta-cateninin adamantinomatous craniopharyngiomas but not in other tumours originating from the sellar region. Acta Neuropathol 109:589-597, 2005
6. Càceres A: Intracavitary therapeutic options in the management of cystic craniopharyngioma. Childs Nerv Syst 21: 705-718, 2005
7. Cavalheiro S, Di Rocco C, Valenzuela S, Dastoli PA, Tamburrini G, Massimi L, Nicacio JM, Faqouini IV, Ierardi DF, Silva NS, Pettorini BL, Toledo SRC: Craniopharyngiomas: Intratumoral chemotherapy with interferon-a: A multicenter preliminary study with 60 cases. Neurosurg Focus 28(4):E12, 2010
8. Cavallo LM, Solari D, Esposito F, Cappabianca P: The endoscopic endonasal approach for the management of craniopharyngiomas involving the third ventricle. Neurosurg Rev 36:27-38, 2013
9. Chakrabarti I, Amar AP, Couldwell W, Weiss MH: Long-term neurological, visual, and endocrine outcomes following transnasal resection of craniopharyngioma. J Neurosurg 102:650-657, 2005
10. Choux M, Lena G: Craniopharyngioma. Ch.49. In: Apuzzo MLJ, (ed), Surgery of the Third Ventricle. ikinci baskı, Baltimore: Williams & Wilkins, 1998:1143-1181
11. Clark AJ, Cage TA, Aranda D, Parsa AT, Sun PP, Auguste KI, Gupta N: A systematic review of the results of surgery and radiotherapy on tumor control for pediatric craniopharyngioma. Childs Nerv Syst 29:231-238, 2013
12. Combs SE, Thilmann C, Huber PE, Hoess A, Debus J, SchulzErtner D: Achievement of long term control in patients with craniopharyngiomas using high precision stereotactic radiotherapy. Cancer 109:2308-2314, 2007
13. Elliott RE, Jane JA, Wisoff JH: Surgical management of craniopharyngiomas in children: Meta-analysis and comparison of transcranial and transsphenoidal approaches. Neurosurgery 69:630-643, 2011
14. Ersahin Y, Yurtseven T, Ozgiray E, Mutluer S: Craniopharyngiomas in children: Turkey experience. Childs Nerv Syst 21: 766-772, 2005
15. Fahlbusch R, Honegger J, Paulus W, Huk W, Buchfelder M: Surgical treatment of craniopharyngiomas. Experience with 168 patients. J Neurosurg 90:237-250, 1999
16. Fernandez-Miranda JC, Gardner PA, Snyderman CH, Devaney KO, Strojan P, Suarez C, Genden EM, Rinaldo A, Ferlito A: Craniopharyngioma: A pathological, clinical, and surgical review. Head Neck 34:1036 – 1044, 2012
17. Giller CA, Berger BD, Pistenmaa DA, Sklar F, Weprin B, Shapiro K, Winick N, Mulne AF, Delp JL, Gilio JP, Gall KP, Dicke KA, Swift D, Sacco D, Harris-Henderson K, Bowers D: Robotically guided radiosurgery for children. Pediatr Blood Cancer 45(3): 304-310, 2005
18. Hoffman HJ, DeSilva M, Humpreys RP, et al: Agressive surgical management of craniopharyngiomas in children. J Neurosurg 76:47-52, 1992
19. Hofmann BM, Höllig A, Strauss C, Buslei R, Buchfelder M, Fahlbusch R: Results after treatment of craniopharyngiomas: Further experiences with 73 patients since 1997. J Neurosurg 116:373-384, 2012
20. Hofmann BM, Nimsky C, Fahlbusch R: Benefit of 1.5-T intraoperative MR imaging in the surgical treatment of craniopharyngiomas. Acta Neurochir 153:1377 – 1390, 2011
21. Hukin J, Steinbok P, Lafay-Cousin L, Hendson G, Strother D, Mercier C, Samson Y, Howes W, Bouffet E: Intracystic bleomycin therapy for craniopharyngioma in children: The Canadian experience. Cancer 109:2124-2131, 2007
22. Iwata H, Tatewaki K, Inoue M, Yokota N, Baba Y, Nomura R, Shibamoto Y, Sato K: Single and hypofractionated stereotactic radiotherapy with CyberKnife for craniopharyngioma. J Neurooncol 106(3):571-577
23. Izumoto S, Suzuki T, Kinoshita M, Hashiba T, Kagawa N, Wada K, Fujimoto Y, Hashimoto N, Saitoh Y, Maruno M, Yoshimine T: Immunohistochemical detection of female sex hormone receptors in craniopharyngiomas: Correlation with clinical and histological features. Surg Neurol 63:520-525, 2005 24. Jeon C, Kim S, Shin HJ, Nam D-H, Lee J-I, Park K, Kim JH, Jeon BC, Kong DS: The therapeutic efficacy of fractionated radiotherapy and gamma-knife radiosurgery for craniopharyngiomas. J of Clin Neuroscience 18:1621-1625, 2011
25. Julow JV: Intracystic irradiation for craniopharyngiomas. Pituitary 16:34-45, 2013
26. Kickingereder P, Maarouf M, El Majdoub F, Fuetsch M, Lehrke R, Wirths J, Luyken K, Schomaecker K, Treuer H, Voges J, Sturm V: Intracavitary brachytherapy using stereotactically applied phosphorus-32 colloid for treatment of cystic craniopharyngiomas in 53 patients. J Neurooncol 109: 365-374, 2012
27. Kobayashi T, Kida Y, Mori Y, Hasegawa T: Long-term results of gamma knife surgery for treatment of craniopharyngioma in 98 consecutive cases. J Neurosurg Pediatr 103(suppl):482-488, 2005
28. Komotar RJ, Starke RM, Raper DMS, Anand VK, Schwartz TH: Endoscopic endonasal compared with microscopic transsphenoidal and open transcranial resection of craniopharyngiomas. World Neurosurg 77(2):329-341, 2012
29. Komotar RJ, Roguski M, Bruce N: Surgical management of craniopharyngiomas. J Neurooncol 92:283-296, 2009
30. Lee M, Kalani MY, Cheshier S, Gibbs IC, Adler JR, Chang SD: Radiation therapy and CyberKnife radiosurgery in the management of craniopharyngiomas. Neurosurg Focus 24(5):E4, 2008
31. Lefranc F, Chevalier C, Vinchon M, Dhellemmes P, Schuring M, Kaltner H, Brotchi J, Ruchoux M, Gabius HJ, Salmon I, Kiss R: Characterization of the levels of expression of retinoic asid receptors, galectin-3, macrophage migrationinhibiting facrtor, and p53 in 51 adamantinomatous craniopharyngiomas. J Neurosurg 98:145-153, 2003
32. Leng LZ, Greenfield JP, Souweidane MM, Anand VK, Schwartz TH: Endoscopic, endonasal resection of craniopharyngiomas: Analysis of outcome including extent of resection, cerebrospinal fluid leak, return to preoperative productivity, and body mass index. Neurosurgery 70:110 -124, 2012 33. Lıu X, Yu Q, Zhang Z, Zhang Y, Li Y, Liu D, Jıa Q, Zheng L, Xu D: Same-day stereotactic aspiration and gamma knife surgery for cystic intracranial tumors. J Neurosurg (Suppl) 117: 45-48, 2012
34. Merchant TE, Kun LE, Hua C-H, Wu S, Xiong X, Sanford RA, Boop FA: Disease control after reduced volume conformal and intensity modulated radiation therapy for childhood craniopharyngioma. Int J Radiat Oncol Biol Phys 85(4):e187- 92, 2013
35. Minniti G, Saran F, Traish D, Soomal R, Sardell S, Gonsalves A, Ashley S, Warrington J, Burke K, Mosleh-Shirazi A, Brada M: Fractionated stereotactic conformal radiotherapy following conservative surgery in the control of craniopharyngiomas. Radiother Oncol 82:90-95, 2007
36. Niranjan A, Kano H, Mathieu D, Kondziolka D, Flickinger JC, Lunsford LD: Radiosurgery for craniopharyngioma. Int J Radiat Oncol Biol Phys 78(1):64-71, 2010
37. Oikonomou E, Barreto DC, Soares B, De Marco L, Buchfelder M, Adams EF: Beta-catenin mutations in craniopharyngiomas and pituitary adenomas. J Neurooncol 73:205-209, 2005
38. Pascual JM, Prieto R, Carrasco R. Infundibulo-tuberal or not strictly intraventricular craniopharyngioma: Evidence for a major topographical category. Acta Neurochir 153: 2403-2426, 2011
39. Prieto R, Pascual JM, Subhi-Issa I, Jorquera M, Yus M, Martinez R: Predictive factors for craniopharyngioma recuurence: A systematic review and illustrative case report of a rapid recurrence. World Neurosurg 79(5-6):733-749, 2013
40. Puget S: Treatment strategies in childhood craniopharyngioma. Front Endocrinol (Lausanne) 3:64, 2012
41. Rigante M, Massimi L, Parrilla C, Galli J, Caldarelli M, Di Rocco C, Paludetti G: Endoscopic transsphenoidal approach versus microscopic approach in children. International Journal of Pediatric Otorhinolaryngology 75:1132-1136, 2011
42. Samii M, Samii A: Surgical management of craniopharyngiomas. Schmidek HH, Sweet WH (ed), Operative neurosurgical techniques, cilt:3, Philadelphia: WB Saunders, 1995:357-370
43. Xu Z, Yen CP, Schlesinger D, Sheehan J: Outcomes of Gamma Knife surgery for craniopharyngiomas. J Neurooncol 104(1):305-313, 2011
44. Yamada S, Fukuhara N, Oyama K, Takeshita A, Takeuchi Y, Ito J, Inoshita N: Surgical outcome in 90 patients with craniopharyngioma: An evaluation of transsphenoidal surgery. World Neurosurg 74(2-3):320-330, 2010
45. Yasargil MG, Curcic M, Kis M, Siegenthaler G, Teddy PJ, Roth P: Total removal of craniopharyngiomas. Approaches and longterm results in 144 patients. J Neurosurg 73:3-11, 1990
46. Yeung JT, Pollack IF, Panigrahy A, Jakacki J: Pegylated interferon-a-2b for children with recurrent craniopharyngioma. J Neurosurg Pediatrics 10:498-503, 2012
47. Yomo S, Hayashi M, Chernov M, Tamura N, Izawa M, Okada Y, Hori T, Iseki H: Stereotactic radiosurgery of residual or recurrent craniopharyngioma: New treatment concept using Leksell gamma knife model C with automatic positioning system. Stereotact Funct Neurosurg 87(6):360-367, 2009
48. Zacharia BE, Bruce SS, Goldstein H, Malone HR, Neugut AI, Bruce JN: Incidence, treatment and survival of patients with craniopharyngioma in the surveillance, epidemiology and end results program. Neuro-Oncology 14(8):1070-1078, 2012
