ХОРДОМА
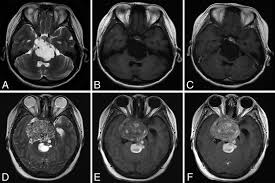
ХОРДОМЫ ОСНОВАНИЯ ЧЕРЕПА
Аннотация
Хордомы представляют собой редкие, медленно растущие, локально агрессивные опухоли, которые, как считается, происходят из хорды эмбриона.
Хотя хордомы вдоль всего позвоночника являются гистологически доброкачественными, они имеют высокую частоту местных рецидивов и встречаются редко.
Они также могут метастазировать. С точки зрения клинического поведения хордомы можно рассматривать как две отдельные группы, которые растут медленно и быстро/агрессивно. Наиболее распространенными симптомами являются двоение в глазах и головная боль.
Наиболее эффективным является хирургическое иссечение, но при хирургическом лечении хордом опухоль носит инфильтративно-деструктивный характер и близка к сосудисто-нервным структурам.
Резекция часто невозможна из-за их близости к жизненно важным нервным окончаниям и того, что опухоль достигла больших объемов на момент диагностики.
Большинству пациентов требуется адъювантная терапия. Методы радиохирургии в лечении резидуальных/рецидивных опухолей доказали свою эффективность.
Важнейший фактор клинического поведения опухоли и прогноза пациента это биология опухоли.
Общепринятой стратегией лечения в мире является хирургическое удаление опухоли, не вызывающее дополнительных неврологических осложнений и сохранение качество жизни.
История изучения хордомы
Хордома была впервые описана Luschka в 1856 году. Вирхов в 1857 году определил классический тип клеток опухоли как физалифорные клетки, и предположил, что хордома может иметь хрящевое происхождение. Zülch впервые заявил, что среди хордром есть разные прогностические группы. Мюллер считал, что эти опухоли имеют происхождение из хорды в 1858 году, и это было подтверждено Гётцем в 1997 году с демонстрацией экспрессии галектина-3. Клебс впервые описал компрессию Варолиева моста из-за хордомы в 1864 году. Фишер и Штайнер описали модель злокачественной хордомы у кроликов, используя теорию Мюллера. Кушинг провел первую успешную хирургическую резекцию хордомы в 1909 году. Heffelfinger, с другой стороны, описал хордому хондроидного типа в 1910 году.
Частота заболеваемости
Хордома — редкая опухоль. Информация о заболеваемости в литературе варьируется. Заболеваемость в разных сериях составляет 0,2%. Хотя сообщалось и о 6,15%, в большой серии заболеваемость составила 0,08 на сто тысяч.
Хордомы и хондросаркомы не дифференцированы друг от друга во многих клинических сериях из-за сходной анатомической локализации и сходной гистопатологии.
В исследованиях сообщалось, что они составляют 0,2% всех внутричерепных опухолей, 6% всех опухолей основания черепа и 1-4% всех злокачественных новообразований костей.
32 % хордом возникают в основании черепа, 33 % — в позвоночнике и 29 % — в крестце. Гендерное распределение однородно в случаях основания черепа. Обычно хордомы выявляют в возрасте 50-60 лет, заболеваемость составляет 5% в возрасте до 20 лет, и в этой возрастной группе сообщается о более агрессивном клиническом течении. Хордомы составляют 17,5% всех опухолей позвоночника и являются 4-й по частоте патологией среди первичных опухолей костей.
ПАТОГЕНЕЗ ХОРДОМЫ
Хотя многое еще неизвестно о происхождении хордом, наши знания о развитии опухолей значительно расширились за последние годы. Гипотеза о том, что хородомы возникают из остатков нотохорд, была выдвинута Мюллером в 1858 г. В работах Schisano и Raffel в 1982 году сообщалось, что локализация в основании черепа была базисно-затылочной и базисфеноидальной. Эти локализации опухоли коррелируют с локализацией нотохордальных остатков.
После этих исследований, подтверждающих, что хордомы происходят из нотохордальных остатков, селективная дупликация гена Brachyury была продемонстрирована в семейных хордомах, и было сообщено, что этот белок избыточно экспрессируется в спорадических хордомах. Hsu определил, что этот белок, который экспрессируется и впоследствии теряется в примитивной хорде, останавливает созревание in vitro.
ПАТАЛОГИЯ ХОРДОМЫ
Хордомы — медленно растущие, некапсулярные, местно-инвазивные, редко метастатические опухоли. Ее можно увидеть во многих анатомических локализациях в основании черепа. Наиболее частая локализация — вокруг клиновидно-затылочного синхондроза. Метастазы возникают у 3-48% больных; чаще всего как, крестцово-копчиковыми локализованными опухолями и могут протекать бессимптомно. Хордомы располагаются экстрааксиально. Чистые интрадуральные хордомы встречаются очень редко. При макроскопическом исследовании они представляют собой желеобразные и дольчатые поражения.
В патологической классификации выделяют классический, хондроидный или дедифференцированный типы. Световая микроскопия показывает доброкачественный вид, несмотря на злокачественное поведение.
Исследование классической хордомы выявляет четкие, но зернистые клетки. Псевдокапсула хордом образуется в результате инфильтрации мягких тканей у основания черепа.
Цитоплазма эозинофильна и положительна по PAS (Periodic Acid Schiff). Они содержат клетки, известные как физалифорные клетки, с более крупными эксцентричными ядрами, сетчатой цитоплазмой, содержащей вакуоли. Эти клетки специфичны для хордом. Описаны «многоклеточные хордомы» с меньшим количеством внеклеточного матрикса и вариации классической хордомы и «липоидные хордомы» с клетками, напоминающими адипоциты.
Хондроидные хордомы, впервые описанные Heffelfinger, гистологически отличаются от других хордом наличием островков клеток, напоминающих хондроциты, в лакунарных областях. Многие считают это поражение подтипом хордомы. В редких случаях хордомы могут содержать участки, напоминающие круглоклеточные опухоли или веретеноклеточные саркомы. Они называются дифференцированными хордами; и имеют агрессивное поведение и плохой прогноз. Чаще встречается у детей и чаще локализуется в крестцово-копчиковой области. Диффреренцированные хордомы встречаются в 4% случаев первичного заболевания. Этот показатель может достигать 9% у пациентов с рецидивом.
Хотя хондросаркомы встречаются в сходных локализациях и имеют сходную морфологию, они проявляют более предсказуемое и доброкачественное поведение, чем хордомы.
Диагнозы хордомы, плеоморфной аденомы, муцинозной аденокарциномы и хондросаркомы можно спутать друг с другом, и это различие можно провести с помощью иммуногистохимических методов. Фактор транскрипции под названием Brachyury, играет важную роль в патогенезе хордомы, занял свое место в качестве белка для диагностики хордом. Кроме того, хондросаркомы, которые могут имитировать кодирование рентгенологически и морфологически, несут мутацию изоцитратдегидрогеназы (IDH), что является важным подспорьем в дифференциальной диагностике.
КЛИНИЧЕСКИЕ ДАННЫЕ ХОРДОМЫ
Хордомы могут располагаться по всему позвоночнику, от черепной области до крестцово-копчиковой области. Естественно, клинические данные зависят от локализации и размера опухоли. Обычно пациенты обращаются в клинику с невропатологическими осложнениями, которые быстро развились после таких симптомов, как боль в голове или шее, длящихся годами.
Хирургические тотальные резекции хордом основания черепа, в отличие от спинальных хордом, редко возможны. Хотя биология в первую очередь определяет течение заболевания, высокая степень хирургической резекции удлиняет продолжительность жизни. При нелеченых хордомах медиана выживаемости после появления симптомов составляет 6-28 месяцев. Поэтому следует лечить диагностированные случаи симптоматической хордомы. Не существует оптимального лечения, которое можно было бы применить ко всем видам хордомы. После операции, лучевой терапии или их комбинации продолжительность жизни увеличивается с 3,6 до 6,6 лет. В зависимости от внутренней биологии опухоли среднее время между появлением симптомов и клиническим диагнозом составляет от 1 недели до 16 лет.
Во всех исследованиях хордом особое внимание заслуживают две группы, резко отличающиеся друг от друга по своему прогнозу.
Первая из них — это группа с неблагоприятным прогнозом, что приводит к летальному исходу в течение 3—5 лет, а другая — группа с хорошим прогнозом и медленным течением. На сегодняшний день многие ученые исследовали характеристики этих двух групп. Lows заявил в 2001 году, что разница между этими двумя группами была основана на внутренней биологии хордомы.
Черепные хордомы проявляют клинические признаки на 10 лет раньше крестцовых хордом. Диплопия и головная боль наиболее распространенные симптомы. При этом наиболее часто встречается паралич 6-й, а затем 3-й и 4-й пар черепа соответственно, у 50% больных обнаруживается птоз.
ДИАГНОСТИКА ХОРДОМЫ
Истинный диагноз хордомы ставится патологоанатомическим исследованием. Но радиологическая визуализация; рентген, компьютеризированная томография (КТ) и магнитно-резонансная томография помогают определить характеристики опухоли. В исследованиях, проводимых с помощью современных технологий, хордома и хондросаркома не могут быть надежно отделены друг от друга с помощью рентгенологических исследований до операции. Хордомы и хондросаркомы опухоли мезенхимального происхождения, но имеют разные биологические особенности. Их можно увидеть на одной нервной оси. Классическим видом черепных хордом это скат в виде симметричной инфильтрирующей опухоли. На томографии будет видно, что опухоль из мягкой ткани вызывает деструкцию костной ткани. КТ лучше показывает различие, особенно при демонстрации инвазии черепных отверстий.
Магнитно-резонансная томография (МРТ) золотой стандарт визуализации хордом. МРТ четко показывает, что, хордомы возникают из ската и видны как однородные, гипоинтенсивные поражения, которые вызывают экспансивную деструкцию кости. В Т1-взвешенных исследованиях они гетерогенные, гипоинтенсивные на Т2-взвешенных изображениях они представляют собой гетерогенные, гиперинтенсивные очаги, которые могут удерживать различное количество контраста.
Хордомы наиболее распространенные опухоли в скате после метастазов. Нормальный скат имеет низкую интенсивность сигнала на МРТ, а сигнал Т1 с возрастом еще больше снижается из-за увеличения количества жира в костном мозге. При МРТ-исследованиях видно, что хордомы растут, образуя дольки. Хордомы и хондросаркомы легко отличить от других опухолей, расположенных в скате. Патологиями, включенными в дифференциальный диагноз, являются менингиомы, инвазивные аденомы гипофиза, плазмоцитомы, метастатические опухоли, карциномы клиновидной пазухи, карциномы носоглотки, лимфомы, гранулематозные заболевания и опухоли хряща. Однако нет надежного признака, который мог бы отличить хордомы от хондросарком или хондроидных подтипов с другим прогнозом.
В литературе высказывается предположение, что хордомы и хондросаркомы можно отличить друг от друга рентгенологически. Однако в проведенном в нашей клинике исследовании, в котором обсуждались рентгенологические признаки, было показано, что ни один из заявленных в литературе результатов визуализации не позволяет отличить хордомы от хондросарком.
Церебральные ангиографические исследования необходимы, если внутричерепные сосудистые структуры сужены, вовлечены или деформированы опухолью. DSA ценен для визуализации венозной системы. Тест на окклюзию можно применять, если предполагается, что внутреннею сонную артерию необходимо закрыть во время операции.
Интраоперационное УЗИ, КТ и МРТ важны для уменьшения остаточного объема опухоли во время операций на основании черепа.
ЛЕЧЕНИЕ ХОРДОМЫ
Первичным лечением следует считать оперативное вмешательство при обнаружении рентгенологического изображения хордомы. После появления симптомов при нелеченых хордомах средняя выживаемость составляет 28 месяцев.
Долгая ожидаемая продолжительность жизни требует, чтобы хордомы не оставались в своем естественном течении и удалялись сколько возможно при малых размерах. Добавление к хирургии лучевой терапии увеличивает среднюю продолжительность жизни. Описаны частичная, субтотальная, радикальная резекция и различные формы лучевой терапии. Более высокая частота резекции приводит к более длительному выживанию. Радикальная резекция и стереотаксическая радиохирургия или использование излучения заряженных частиц обеспечивает эффективный контроль над опухолью и улучшает качество жизни. Средняя продолжительность жизни после операции, лучевой терапии или их комбинации составляет от 3,6 до 6,6 лет. Хордомы — это медленно и инвазивно растущие опухоли. Требуется хирургический комбинированный и комплексный подход. В серии, выполненной в нашей клинике, чаще рецидивировали опухоли объемом более 20 см3. Также показано, что лечение гамма-ножом в раннем периоде более эффективно, чем в позднем. При остаточном объеме опухоли более 30 см3 целесообразно повторно оперировать больного.
ХИРУРГИЯ ХОРДОМЫ ГОЛОВНОГО МОЗГА
Во всем мире принято, что максимальные и безопасные резекции опухолей хордомы составляют основу лечения. Широкие резекции единым блоком невозможны из-за расположения и размера хордом в основании черепа и окружающих их сосудисто-нервных структур.
Хирургические стратегии основаны на внутриочаговых резекциях опухоли с целью тотальной резекции. Не существует золотого стандарта для того, какой тип хирургии лучше всего подходит для пациентов. Проведенные на сегодняшний день исследования показали, что пациенты получают пользу от более радикальной хирургии. Многие исследования показывают обратную зависимость между частотой рецидивов и частотой резекций. Эта связь более выражена, особенно у молодых пациентов. Рутинное использование вмешательств на основании черепа снизило частоту остаточных опухолей с 20% до 9,2%.
В то время как транссфеноидальный, трансчелюстной, трансназальный, шейный передний заглоточный и трансоральный доступы используются для резекции хордомы, эндоскопические методы стали важной частью в последние годы. Не существует единого хирургического подхода, с помощью которого мы могли бы лечить все случаи хордомы. Выбираемая хирургическая техника должна учитывать локализацию опухоли, ее протяженность, характер роста и близость к окружающим жизненно важным тканям и твердой мозговой оболочке.
Как правило, доступ к хордомам, расположенным в центре основания черепа, осуществляется передним доступом, а к хордомам с латеральным распространением — латеральным. Хордомы, остающиеся по средней линии краниовертебрального перехода, могут быть иссечены срединным субфронтальным, трансчелюстным или трансоральным доступами. Опухоли, которые распространяются латерально в краниовертебральном переходе, могут быть достигнуты с крайним латеральным доступом. Хирургия может быть дополнительно улучшена с использованием интраоперационной МРТ 3 Тесла и с помощью нейронавигации.
В последние годы, с развитием радиохирургии в хирургии хордом, все чаще стали использовать не радикальное оперативное лечение, а контролируемую резекцию с максимальным сохранением сосудисто-нервной структуры.
Передний доступ
Передние доступы включают передний срединный субфронтальный, транссфеноидальный, передний срединный лицевой, трансоральный и переднебоковой доступы.
Субфронтальный доступ
К опухолям с супраселлярным распространением в дополнение к кливальной опухоли срединная субфронтальная краниотомия подходит как доступ для резекции. Часто используются трансбазальный доступ Derome и расширенный субфронтальный доступ Sekhar, сочетающий бифронтальные краниотомии и орбитоназальные остеотомии и их модификации. После этмоидальных подходов возникающую в результате аносмию можно избежать, сохранив обонятельные функции с помощью циркулярной остеотомии вокруг решетчатой пластинки. В этом доступе граница, доступная латерально, определяется зрительными нервами, верхушкой каменистой кости, отводящим нервом и подъязычными каналами, и, если необходимо пересечь эти анатомические барьеры, следует также добавить латеральный доступ. Эти вмешательства обеспечивают глубокое поле зрения до уровня C2 с минимальной ретракцией головного мозга. Однако доступ к боковым структурам ограничен. Корешки тройничного нерва и подъязычные нервы на уровне ската образуют боковые границы подхода.
Транссфеноидальные доступы и передняя кливэктомия
При подходящих опухолях транссфеноидальная хирургия обеспечивает прямой, короткий и относительно менее инвазивный подход к хордомам ската. Стандартный транссфеноидальный доступ может быть модифицирован для лечения различных опухолевых расширений в пределах ската или до ствола мозга и может даже выполняться как передняя кливэктомия. Трансоральные доступы обеспечивают распространение экстрадуральных очагов с переди от краниовертебрального перехода без исключения ствола головного мозга. При стандартном вмешательстве простирается от нижней 1/3 ската до каудального С3. Она разделяет мягкое или твердое небо и распространяется на верхние отделы ската и латерально на яремное отверстие. Вовлечение параселлярных структур хордомами является распространенным явлением. Переднебоковые доступы необходимы в случаях бокового и латерального удлинения. Для резекции Клавиально рассположенной опухоли с супраселлярным расширением подходит передний или латеральный транскраниальный доступ. Опухоли краниовертебрального перехода удаляют через субфронтальный, максиллотомический и трансоральный доступ.
Трансчелюстные доступы.
Трансчхелюстные доступы подходят к опухолям с экстрадуральным распространением от клиновидной кости до верхнего и среднего ската и при поражениях с минимальным боковым распространением. Его также можно использовать при интрадуральных поражениях, но латеральный доступ предпочтительнее при интрадуральных поражениях. При таком подходе боковые границы; медиальная крыловидная пластина, ВСА на уровне большого затылочного отверстия, кавернозного синуса, подъязычных протоков и яремного отверстия. В дополнение к доступу максиллэктомии, срединные сагиттальные вмешательства на верхней челюсти и мягком небе обеспечивают широкое поле зрения. Расширенный транссфеноидальный или трансэтмоидальный доступ можно использовать с остеотомией верхней челюсти ипсилатерально по отношению к поражению, при опухолях, поражающих верхнюю часть ската, турецкое седло или медиальную часть кавернозного синуса.
Переднебоковые доступы
Фронто-орбито-скуловой доступ применяют при опухолях, расположенных в верхней части ската, распространяющихся латерально в кавернозный синус и прорастающих в интрадуральные структуры. Преимущества такого доступа: минимальная ретракция головного мозга, короткий путь к очагу поражения, круговой обзор, отсутствие контаминации.
Латеральный доступ
Латеральные доступы подходят к среднему основанию черепа от дна средней ямки. Подвисочный доступ внутренний слуховой проход имеет стандартный доступ к средней ямке и расширения. При нижнелатеральных доступах можно открыть височно-нижнечелюстной сустав и подойти к опухоли из подвисочной ямки.
Задний доступ
Включает пресигмовидный и далеко латеральный/крайне латеральный доступы.
Пресигмовидный доступ
Пресигмовидные доступы сочетают простую мастоидэктомию с петрозэктомией различной степени. Объем петрозэктомии определяется предоперационными данными пациента и хирургической необходимостью и варьируется от частичной лабиринтэктомии до тотальной лабиринтэктомии и петрозэктомии. Транслабиринтный доступ позволяет увидеть переднебоковой отдел ствола мозга и мостомозжечковый угол. Все эти доступы можно сочетать с переднебоковыми или дальнелатеральными вмешательствами в хирургии больших и распространенных опухолей.
Дальне-боковой доступ
Обеспечивает доступ к хордомам, расположенным в нижней части ската и распространяющимся латеральнее краниовертебрального перехода. Поскольку хордомы располагаются спереди или переднебоково от ствола головного мозга, крайне важен боковой вид краниовертебрального перехода, получаемый при таком доступе.
Экстремально-латеральный транс мыщелковый доступ
Применяется при опухолях вокруг нижнего отдела ската и краниоцервикального перехода. Обеспечивает короткий и широкий путь.
При опухолях, поражающих затылочные мыщелки, стабилизация краниоцервикального перехода может быть выполнена за один сеанс.
АДЪЮВАНТНОЕ ЛЕЧЕНИЕ ХОРДОМЫ
Подавляющее большинство хордом рецидивируют после операции, поэтому почти всегда требуется адъювантная терапия.
Неэффективность традиционных методов лучевой терапии привела к идее, что хордомы являются радиорезистентными, но многообещающие результаты, опубликованные в последние годы с использованием методов облучения частиц и радиохирургии, придали импульс исследованиям по этому вопросу.
Традиционная радиотерапия
Лучевая терапия используется при подавляющем большинстве резидуальных и рецидивных опухолей. Результаты лучевой терапии в одиночку хуже, чем лучевая терапия после хирургического лечения.
Чтобы предотвратить повреждение зрительного нерва и ствола головного мозга, при традиционной лучевой терапии при хордомах основания черепа можно применять только умеренные дозы.
Сообщаемая 5-летняя выживаемость без прогрессирования при традиционной лучевой терапии составляет 17-39%. В различных исследованиях предполагалось, что более успешные результаты могут быть получены при увеличении доз облучения. При использовании современного оборудования и протоколов 5-летняя выживаемость без прогрессирования, которая может быть достигнута с помощью лучевой терапии, составляет около 50%. Однако в большинстве случаев добиться долгосрочного контроля над опухолью невозможно. Испытываются такие подходы, как сочетание лучевой терапии с радиохирургией и добавление к лечению радиосенсибилизирующих агентов. Большинство хордом рецидивируют после хирургической резекции, и почти всегда требуется какая-либо форма адъювантной терапии. Поэтому лучевая терапия используется для обеспечения локального контроля. Достижения в области радиационных технологий (лечение высокоэнергетическими частицами) это меньшее повреждение окружающих тканей с помощью более высоких доз лучевой терапии.
Радиохирургия
Методики радиохирургии основаны на принципе направления максимального луча на очаг поражения с минимальными побочными эффектами на окружающие ткани при дозиметрическом планировании.
Наиболее эффективным методом лечения хордом, принятым сегодня во многих онкологических центрах, является широкое иссечение единым блоком, это лечение высокоэнергетическими частицами (например, ProtonBeam).
Гамма-нож важен для первичного адъювантного лечения хордом небольшого размера, но его эффект более ограничен при рецидивирующих поражениях.
Среди адъювантных методов лечения наиболее эффективным является протонная радиохирургия. Это очень высокоэнергетическая радиохирургическая техника.
Austin-Seymour сообщил о результатах лечения 68 пациентов, получивших послеоперационную высокодозную протонную радиохирургию (средняя доза опухоли 69 Гр). У этих пациентов, которые наблюдались в течение 17-152 месяцев, 5-летний уровень местного контроля опухоли составил 82%, а выживаемость без рецидива - 76%.
Лучший прогноз показан у мужчин и при небольших опухолях. Доза Др. Мюнценридер сообщил что при дозе облучения 56,8-75,6 сГр 5-летняя безрецидивная выживаемость составила 76%, а общая выживаемость составила 90% у 194 пациентов.
Доктор Хуг описал 58 пациентов с хордомой основания черепа и хондросаркомой, которые получали протонную лучевую терапию в дозах 64,8-79,2 сГр. 5-летний уровень местного контроля опухоли составил 75% для хондросарком и 59% для хордом. В этой публикации сообщалось, что объем опухоли и поражение ствола головного мозга не влияли на контрольное соотношение.
Результаты невысокоэнергетических методов радиохирургии не столь однозначны. Мутукумар и др. заявили, что операция гамма-ножа является альтернативой микрохирургии у 15 пациентов с хордомой основания черепа и хондросаркомой. При максимальной дозе опухоли 24-40 Гр, средняя доза 36 Гр и доза края опухоли 12-20 Гр, средняя 18 Гр были изучены у 8 пациентов со средним размером опухолей 4,6 мл, из которых 3 оставались стабильными и 4 умерли.
Радиохирургия рассматривается как безопасный метод для опухолей небольшого объема. Дебус и др. Они обнаружили, что 5-летняя выживаемость 45 пациентов с хордомой или хондросаркомой, получавших фракционированную стереотаксическую лучевую терапию, составила 50% и 82%. Небольшие размеры и расположение являются важными критериями стереотаксической радиохирургии.
МЕДИКАМЕНТОЗНОЕ ЛЕЧЕНИE ХОРДОМЫ
Антрациклин, цисплатин, аналоги камптотецина и щелочные вещества были опробованы при лечении хордомы, и было показано, что эти классические химиотерапевтические средства не оказывают существенного эффекта при лечении.
Молекулярные мишени, возникающие с более подробным пониманием онкогенеза хордомы, вызвали интерес к новым потенциально эффективным методам лечения.
Когда все варианты лечения исчерпаны, можно рекомендовать химиотерапию как паллиативное лечение. Поскольку нет четкой терапевтической цели для рационального лечения, хордомы в основном лечат схемами химиотерапии, разработанными для сарком, и, как сообщается, большинство из них не имеют терапевтического ответа или имеют небольшой терапевтический эффект.
Винбластин, актиномицин-d, циклофосфамид, метотрексат, хлорамбуцил были опробованы при лечении хордомы, и сообщалось, что результаты были плохими.
Молекулярно-биологические исследования хордомы показал, что опухоли экспрессируют подтипы PDGFR и рецепторы KIT. Эти изменения открыли двери для использования таргетной терапии.
В ограниченном количестве сообщений о случаях применения иматиниба и сунитиниба при хордомах сообщалось об использовании ингибиторов тирозинкиназы и частичном ответе на эти препараты, но эти результаты являются не подтвержденными, и в настоящее время нет точных данных основанных на проспективных рандомизированных контролируемых исследованиях. (Информация 2014 года)
Заключение
Хордомы, которые часто локализуются в основании черепа, являются локальными агрессивными опухолями и плохо поддаются лечению. Цель хирургического лечения обеспечение максимально безопасных резекций хордомы. Эффект от радиотерапевтических технологий высок, особенно при небольших остаточных опухолях. Сообщаемая медиана выживаемости 6,29 года указывает на то, что прогноз этого заболевания не является оптимальным, несмотря на современные технологии и достижения. Более детальное понимание биологии заболевания, может позволить новые разработки в лечении.
Источники
1. Al-Mefty O, Borba LAB: Skull base chordomas: A management challenge. J Neurosurg 86:182-189, 1997
2. Al-Mefty O, Kadri PA, Hasan DM, Isolan GR, Pravdenkova S: Anterior clivectomy: Surgical technique and clinical applications. J Neurosurg 109(5):783-793,2008
3. Al-Mefty O, Fox JL, Smith RR: Petrosal approach for petroclival meningiomas. Neurosurgery 22:510-517, 1988
4. Alezais MM, Peyron A: Contribution a letude des chordomes; Chordomes de la region occipitale, Paris: 1914
5. Amary MF, Bacsi K, Maggiani F, Damato S, Halai D, Berisha F, Pollock R, O’Donnell P, Grigoriadis A, Diss T, Eskandarpour M, Presneau N, Hogendoorn PC, Futreal A, Tirabosco R, Flanagan AM: IDH1 and IDH2 mutations are frequent events in central chondrosarcoma and central and periosteal chondromas but not in other mesenchymal tumours. J Pathol 224(3):334-343, 2011
6. Amendola BE, Amendola MA, Oliver E, et al: Chordoma: Role of radiation therapy. Radiology 158:839-843, 1986
7. Arnold H, Herrmann HD: Skull base chordoma with cavernous sinus involvement. Partial or radical tumor-removal? Acta Neurochir 83:31-37, 1986
8. Austin-Seymour M, Munzenrider J, Goitein M, Verhey L, Urie M, Gentry R, Birnbaum S, Ruotolo D, McManus P, Skates S, et al: Fractionated proton radiation therapy of chordoma and low-grade chondrosarcoma of the base of the skull. J Neurosurg 70:13-17, 1989
9. Azzarelli A,Quagliuolo V, Cerasoli S, Zucali R, Bignami P, Mazzaferro V, Dossena G, Gennari L: Chordoma: Natural history and treatment results in 33 cases. J Surg Oncol 37:185-191,1988
10. Becker D, Ammirati M, Black K, Canalis R, Andrews J: Transzygomtaic approach to tumors of the parasellar region. Technical note. Acta Neurochir Suppl 53:80-91
11. Catton C, O’Sullivan B, Bell R, Laperriere N, Cummings B, Fornasier V, Wunder J: Chordoma: Long-term follow-up after radical photon irradiation. Radiother Oncol 41: 67-72, 1996
12. Casali PG, Messina A, Stacchiotti S, et al: Imatinip mesylate in Chordoma. Cancer 101: 2086-2097, 2004
13. Debus J, Schulz-Ertner D, Schad L, et al: Stereotactic fractionated radiotherapy for chordomas and chondrosarcomas of the skull base. Int J Radiat Oncol Biol Phys 47:591-596, 2000
14. Derome PJ: Surgical management of tumors invading the skull base. Can J Neurol Sci 12:345-347, 1985
15. Derome PJ: Surgical management of tumors invading the skull base. Can J Neurol Sci 12:345-347, 1985
16. Dolenc VV: Transcranial epidural approach to pitutary tumors extending beyond the sella. Neurosurgery 41:542-550; discussion 551-552, 1997
17. Doucet V, Peretti-Viton P, Figearella –Branger D, Manera L, Salamon G: MRI of intacranial chordomas. Extent of tumour and contrast enhancement criteria for differential diagnosis. Neuroradiology 39:571-576, 1997
18. Ekinci G, Akpinar IN, Baltacioglu F, Erzen C, Kilic T, Elmaci I, Pamir MN: Early postoperative magnetic resonance imaging in glial tumors: Prediction of tumor regrowth and reccurence. Euro J Radiol 45:99-107, 2003
19. Goel A: Extended middle fossa approach for petroclival lesions. Acta Neurochir (Wien) 135:78-83, 1995
20. Harsh GR, Sekhar LN: The subtemporal, transcavernous, anterior transpetrosal approach to the upper brain stem and clivus. J Neurosurg 77:709-717, 1992 21. Hsu W, Mohyeldin A, Shah SR, et al: Generation of Chordoma cell line JHC7 and identification of Brachyury as a novel moleculer target. J Neurosurg 115: 760- 769, 2011
22. Hug EB: Review of skull base chordomas: Prognostic factors and long-term results of proton-beam radiotherapy. Neurosurg Focus 10(3):E11, 2001
23. Kimura F, Kim KS, Freidman H, Russel EJ, Breit R: MR imaging of normal and abnormal clivus. Am J Neuroradiology 11: 1015-1021, 1990
24. Lanzino G, Dumont AS, Lopes MB, Laws ER Jr: Skull base chordomas: Overview of disease, management options, and outcome. Neurosurg Focus 10(3):E12, 2001
25. Menezes AH, Gantz BJ, Traynelis VC, et al: Cranial base chordomas. Clin Neurosurg 44:491-509, 1997
26. Munzenrider JE, Austin-Saymour M, Blitzer PJ, et al: Proton therapy at Harvard. Strahlentherapie 161:756-763, 1985
27. Muthukumar N, Kondziolka D, Lunsford LD, et al: Stereotactic radiosurgery for chordoma and chondrosarcoma: Further experiences. Int J Radiat Oncol Biol Phys 41:387-392, 1998
28. Oot RF, Melville GE, New PF, Austin-Seymour M, Munzenrider J, Pile-Spellman J, Spagnoli M, Shoukimas GM, Momose KJ, Carrol R, et al: The role of MR and CT in evaluating clival chordomas and chondrosarcoma. AJR Am J Roentgenol 151: 567-575, 1988
29. Pamir MN, Ozduman K: Tumor-biology and current treatment of skull-base chordomas. Adv Tech Stand Neurosurg 33:35- 129, 2008
30. Pamir MN, Peker S, Ozek MM, Dincer A: Intraoperative MR imaging preliminary results with 3 tesla MR system. Acta Neurochir 98 Suppl:97-100, 2006
31. Pamir MN, Ozduman K: Analysis of radiological features relative to histopathology in 42 skull base chordomas and chondrosarcomas. Eur J Radiol 58:461-470, 2006
32. Pamir MN, Kilic T, Ozek MM, Ozduman K, Ture U: Non meningial tumours of the cavernous sinus: A surgical analysis. J Clin Neurosci 13:626-635, 2006
33. Pamir MN, Kilic T, Ture U, Ozek MM: Multimodality management of 26 skull base chordomas with 4 year mean follow-up experience at a single institution. Acta Neurochir (Wien) 146:343-354; discussion 354, 2004
34. Pamir MN, Özduman K: Tumor-biology and current treatment of skull-base chordomas. Turkiye Klinikleri J Surg Med Sci 3(51):116-122, 2007
35. Pamir MN, Ozduman K: Tumor-biology and current treatment of skull-base chordomas. Adv Tech Stand Neurosurg 33: 35-129, 2008
36. Presneau N, Shalaby A, Ye H, Pillay N, Halai D, Idowu B, Tirabosco R, Whitwell D, Jacques TS, Kindblom LG, Brüderlein S, Möller P, Leithner A, Liegl B, Amary FM, Athanasou NN, Hogendoorn PC, Mertens F, Szuhai K, Flanagan AM: Role of the transcription factor T (brachyury) in the pathogenesis of sporadic chordoma: A genetic and functional-based study. J Pathol 223: 327-335, 2010
37. Raffel C, Wright DC, Gutin PH, Wilson CB: Cranial chordomas: Clinical presentation and results of operative and radiation therapy in twenty-six patients. Neurosurgery 17:703-710, 1985
38. Schisano G, Tovi D: Clivus chordomas. Neurochirurgia (Stuttg) 5: 99-120, 1962
39. Sekhar LN, Schramm VL, Jones NF: Subtemporal-peauricular infratemporal fossa approach to large lateral and posterior cranial base neoplasms. J Neurosurg 67:488-499, 1987
40. Sekhar LN, Nanda A, Sen CN, et al: The extended frontal approach to tumors of the anterior, middle, and posterior skull base. J Neurosurg 76:198-206, 1992
41. Walcott BP, Nahed BV, Mohyeldin A, Coumans JV, Kahle KT, Ferreira MJ: Chordoma: Current concepts, management, and future directions. Lancet Oncol13(2):e69-76, 2012
42. Weber AL, Liebsch NJ, Sanchez R, Sweriduk ST Jr: Chordomas of the skullbase. Radilogic and clinical evaluation. Neuroimaging Clin N Am 4:515-527, 1994
