T клеточная терапия и CAR T лечение в Турции
Предварительный отчет академического клинического исследования клеток CAR-T (ISIKOK-19) в Турции: характеристика и результаты клинического применения
Клеточная терапия химерным антигенным рецептором Т (CAR-T) уже оказала влияние на лечение В-клеточных злокачественных новообразований. Tерапия CAR-T-клетками многообещаюшая, финансовый аспект вызывает опасения относительно доступности. В этом предварительном исследовании представлены результаты первого производства и клинические данные академического исследования CAR-T-клеток (ISIKOK-19) в Турции.
Материалы и методы:
Было проведено пилотное клиническое исследование ( NCT04206943 ), предназначенное для оценки безопасности и осуществимости Т-клеточной терапии ISIKOK-19 для пациентов с рецидивирующими и рефрактерными опухолями CD19+, участвующие пациенты получали инфузии ISIKOK-19 в период с октября 2019 г. по июль 2021 г. Производственные данные в этом исследовании представлены первые 8 пациентов и клинические исходы 7 пациентов, получавших клеточные инфузии ISIKOK-19.
Полученные результаты Т клеточной терапии:
В исследование были включены девять пациентов [5 с острым лимфобластным лейкозом (ОЛЛ) и 4 с неходжкинской лимфомой (НХЛ)], но только 7 пациентов могли получить лечение. У 2 из 3 участвовавших пациентов с ОЛЛ и у 3 из 4 пациентов с НХЛ был полный/частичный ответ (общий уровень ответа: 72%). У четырех пациентов (57%) была токсичность, связанная с CAR-T (синдром высвобождения цитокинов, синдром энцефалопатии, связанной с CAR-T, и панцитопения). Два пациента не ответили на лечение и имели прогрессирующее заболевание после терапии CAR-T. У двух пациентов с частичным ответом заболевание прогрессировало во время наблюдения.
Заключение:
Эффективность производства и выполнение критериев контроля качества были удовлетворительными для академической продукции. Частота ответа и профили токсичности также были приемлемыми для этой группы пациентов, получавших интенсивное лечение/резистентных к лечению. Клетки ISIKOK-19 представляются безопасным, экономичным и эффективным вариантом лечения опухолей CD19+. Однако результаты этого исследования должны быть подтверждены текущим в настоящее время клиническим испытанием ISIKOK-19.
Ключевые слова: острый лимфобластный лейкоз, Т-клеточный химерный антигенный рецептор (CAR-T), генная терапия, неходжкинская лимфома.
Введение
Терапия Т-клетками с химерными антигенными рецепторами (CAR-T) уже произвела революцию в лечении В-клеточных злокачественных новообразований [ 1 , 2 ]. Финансовая доступность CAR-T-клеточных продуктов обеспечивает значительный практический опыт лечения рецидивирующих или рефрактерных В-клеточных злокачественных новообразований, но во многих странах существуют опасения относительно коммерческих продуктов в отношении их доступности и устойчивости . Эти опасения вызвали потребность в более экономичном академическом и местном производстве. Следовательно, несколько стран изучают альтернативные модели производства Т-клеток, которые имеют клинические результаты, сравнимые с коммерческими продуктами . ISIKOK-19 — это первый местный CAR-T-клеточный продукт CD19 в Турции, возникший в связи с необходимостью решения проблем с экономикой и доступностью, связанных с использованием коммерческих продуктов.
Результаты клинических данных академического CAR-T клеточного продукта ISIKOK-19 из Турции представлены в этом предварительном отчете. Продукционные данные по ИСИКОК-19 уже были опубликованы [ 6 ] и представлены в качестве дополнительных данных в данном отчете.
Материалы и методы
Пилотное клиническое исследование ( NCT04206943 ), предназначенное для оценки безопасности и осуществимости Т-клеточной терапии ISIKOK-19 у пациентов с рецидивирующими и рефрактерными опухолями CD19+, было проведено в больнице Аджибадем. Протокол клинического исследования был одобрен соответствующим институциональным наблюдательным советом и Департаментом трансплантации крови, органов и тканей Министерства здравоохранения Турции [(56733164/203)/(2019-11/6)].
Все пациенты дали письменное информированное согласие. Участвующие пациенты получали инфузии ISIKOK-19 в период с октября 2019 г. по июль 2021 г. В этом исследовании представлены производственные данные для первых 8 пациентов и клинические результаты 7 пациентов, получивших инфузии клеток ISIKOK-19.
Академический продукт CAR-T-клеток, представленный в этом исследовании, ISIKOK-19, кодирует конструкцию CAR против CD19 с одноцепочечным вариабельным фрагментом (scFv) моноклонального антитела против CD19 (FMC63), конъюгированным с шарнирной областью CD8, Трансмембранный (ТМ) и костимулирующий домен CD28, а также сигнальный домен проактиватора CD3z вместе с укороченной формой белка клеточной поверхности рецептора эпидермального фактора роста (EGFRt) в качестве маркера коэкспрессии и механизма переключения безопасности.
Полученные результаты
В исследование были включены девять пациентов [5 с острым лимфобластным лейкозом (ОЛЛ) и 4 с неходжкинской лимфомой (НХЛ)], но только 7 пациентов смогли получить лечение (Таблица 1, ). Проведено лечение трех пациентов с диффузной крупноклеточной В-клеточной лимфомой (ДВККЛ), трех пациентов с ОЛЛ и одного с двойной лимфомой (ДХЛ). У одного пациента была трансформация DLBCL из хронического лимфоцитарного лейкоза (CLL), а у пациента с DHL произошла трансформация из фолликулярной лимфомы. Все четыре пациента с лимфомой имели рефрактерное заболевание, а у двух пациентов с ОЛЛ было экстрамедуллярное поражение.
Таблица 1
Характеристики пациента.
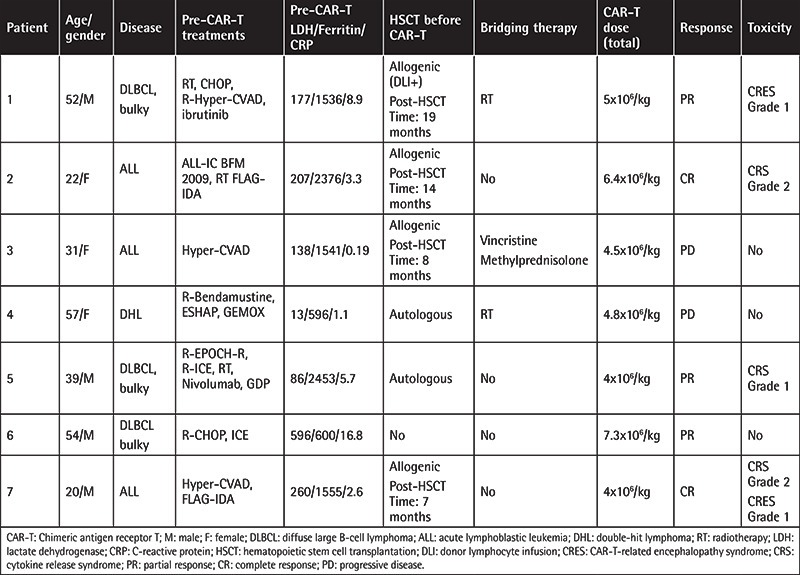
Клинические данные показывают, что исследуемая группа подвергалась очень интенсивному предварительному лечению (медиана линий предыдущей терапии = 4), при этом все, кроме одной, имели в анамнезе трансплантацию гемопоэтических стволовых клеток , включая четырех пациентов, перенесших аллогенную трансплантацию. Время от трансплантации костного мозга до введения ИСИКОК-19 составило 19, 14, 8 и 7 месяцев, а донорский химеризм на момент лейкафереза составил 100%, 98%, 73% и 0% соответственно. Один из пациентов получал терапию ингибиторами контрольных точек (ниволумаб) за 6 мес до инфузии ИСИКОК-19. После инфузии ISIKOK-19 реакции «трансплантат против хозяина» не наблюдалось.
У 2 из 3 пациентов с ОЛЛ и у 3 из 4 пациентов с НХЛ был полный/частичный ответ (общий показатель ответа: 72%). Все пациенты с ДВККЛ получили частичный ответ после инфузии CAR-T-клеток. У всех трех пациентов с ДВККЛ во время инфузии CAR-T было выраженное заболевание. У пациента с DHL после инфузии CAR-T-клеток заболевание прогрессировало. Два пациента с ОЛЛ получили полный ответ, а другой пациент с ОЛЛ не ответил на лечение. У четырех пациентов (57%) была токсичность, связанная с CAR-T [синдром высвобождения цитокинов (CRS), синдром нейротоксичности, связанной с иммунными эффекторными клетками (ICANS) и панцитопения]
Таблица 2
Клинические исходы в зависимости от диагноза.
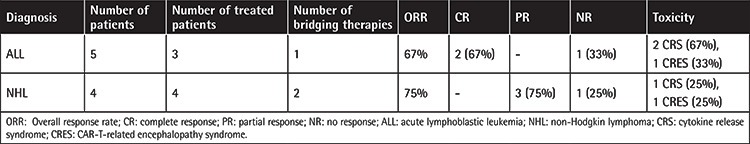
Инфузия ИСИКОК-19 была связана с легкой и преходящей токсичностью; у одного пациента был CRS 1-й степени, а у другого - ICANS 1-й степени, оба из которых разрешились без вмешательства. Одному пациенту с ХРС 2-й степени потребовалась однократная доза тоцилизумаба, после чего он выздоровел. У одного пациента был CRS 2 степени, ICANS 1 степени и гематологическая токсичность с панцитопенией. Для выздоровления ему потребовалось лечение тоцилизумабом и дексаметазоном. Гематологическая токсичность разрешилась к концу второго месяца лечения. Все четыре пациента с CRS или ICANS реагировали на терапию ISIKOK-19. У всех пациентов, за исключением одного, после инфузии ISIKOK-19 развилась В-клеточная аплазия. В-клеточная аплазия длилась дольше у ответивших на лечение пациентов.
Обсуждение
В этом исследовании у 8 пациентов было выполнено 8 аферезов периферических мононуклеарных клеток. Одна попытка производства не удалась, и пациент умер непосредственно перед инфузией CAR-T-клеток. Семь из восьми попыток производства привели к успешным результатам, которые соответствовали всем критериям выпуска и контроля качества.
Четыре из 7 пациентов в этом исследовании имели в анамнезе аллогенную трансплантацию костного мозга до инфузии CAR-T-клеток. Трое из этих 4 пациентов имели высокие коэффициенты донорского химеризма (100%, 98% и 73%) во время лейкафереза, и один из них был нехимерным. Пациенты с высоким донорским химеризмом показали ответ на лечение CAR-T-клетками, тогда как нехимерный пациент не ответил. Этот вывод согласуется с предыдущими сообщениями о CAR-T-клетках у пациентов с высоким донорским химеризмом . Мы предполагаем, что удовлетворительные результаты в случаях с высоким донорским химеризмом могли быть связаны с неистощенными Т-клетками доноров по сравнению с, вероятно, истощенными Т-клетками у ранее сильно обработанных пациентов. Это открытие обнадеживает для лечения CAR-T-клетками из аллогенных источников.
В целом токсичность, наблюдаемая в этом исследовании, была легкой. У всех ответивших на лечение были побочные эффекты, в то время как у не ответивших на лечение токсичность отсутствовала. Этот вывод подтверждает наблюдения относительно положительной корреляции между нежелательными явлениями и эффективностью CAR-T-клеточной терапии в предыдущих отчетах [ 9 , 10 ].
Что касается экспансии CAR-T-клеток in vivo, данные исследования указывают на большее количество копий вектора у респондеров. Сохраняющееся высокое число копий CAR-T и исчезающая позитивность по CD19 у пациентов, реагирующих на лечение, свидетельствовали об эффективности клеток ISIKOK-19. У чувствительных пациентов с лимфомой образцы биопсии после прогрессирования заболевания показали, что прогрессирование происходило в популяции клеток CD19-лимфомы. Этот вывод согласуется с ранее сообщавшимися о высоких показателях CD19-негативности при рецидивах, которые в основном возникали в течение первых 4 месяцев после терапии CAR-T-клетками.
Заключение
В этом отчете представлены производство и клинические результаты первого академического исследования CAR-T-клеточной терапии в Турции. Эффективность производства и критерии контроля качества были выполнены для академической продукции. Частота ответа и профили токсичности были приемлемыми для этой группы пациентов, получавших интенсивное лечение/резистентных к лечению. Клетки ISIKOK-19 представляются безопасным, экономичным и эффективным вариантом лечения опухолей CD19+.
Рекомендации
1. Mullard A. FDA одобряет первую терапию CAR T. Nature Rev Drug Discov. 2017; 16 :669. [ PubMed ] [ Академия Google ]
2. Нилапу С.С., Локк Ф.Л., Бартлетт Н.Л., Лекакис Л.Дж., Миклош Д.Б., Якобсон К.А., Брауншвейг И., Олуволе О.О., Сиддики Т., Лин Ю., Тиммерман Дж.М., Стифф П.Дж., Фридберг Дж.В., Флинн И.В., Гой А., Хилл Б.Т., Смит М.Р., Деол А., Фарук У., МакСвини П., Муньос Дж., Авиви И., Кастро Дж.Э., Вестин Дж.Р., Чавес Дж.К., Гобади А., Командури К.В., Леви Р., Якобсен Э.Д., Витциг Т.Е., Рейган П., Бот А., Росси Дж. , Навале Л., Цзян И., Эйкок Дж., Элиас М., Чанг Д., Визорек Дж., Го В.Я. Axicabtagene ciloleucel CAR Т-клеточная терапия при рефрактерной крупноклеточной В-клеточной лимфоме. N Engl J Med. 2017; 377 : 2531–2544. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
3. Нилапу С.С., Дикинсон М., Ульриксон М.Л., Олуволе О.О., Эррера А.Ф., Тиблемонт С., Уджани С.С., Лин И., Риделл П.А., Кекре Н., де Вос С., Ян И., Миллетти Ф., Гоял Л., Кавасима Дж., Чавес Дж.К. . Промежуточный анализ ZUMA-12: исследование фазы 2 аксикабтагена цилолеуцела (Axi-Cel) в качестве терапии первой линии у пациентов (pts) с крупноклеточной В-клеточной лимфомой высокого риска (LBCL). Кровь . 2020; 136 (Приложение 1) : 49. [ Академия Google ]
4. Шах Н.Н., Хамадани М. Сохраняется ли роль аллогенной трансплантации в лечении лимфомы? Дж. Клин Онкол. 2021; 39 : 487–498. [ PubMed ] [ Академия Google ]
5. Кастелла М., Кабальеро-Баньос М., Ортис-Мальдонадо В., Гонсалес-Наварро Э.А., Сунье Г., Антоньяна-Видосола А., Боронат А., Марсал Б., Миллан Л., Мартин-Антонио Б., Сид Дж., Лосано М., Гарсия Э. , Tabera J, Trias E, Perpiña U, Canals JM, Baumann T, Benítez-Ribas D, Campo E, Yagüe J, Urbano-Ispizua Á, Rives S, Delgado J, Juan M. Point-of-care CAR T-cell производство (ARI-0001) с использованием закрытого полуавтоматического биореактора: опыт академического клинического испытания фазы I. Фронт Иммунол. 2020; 11 :482. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
6. Таштан С., Канчаги Д.Д., Туран Р.Д., Юртсевер Б., Чакырсой Д., Абануз С., Йыланджи М., Сейис У., Озер С., Мерт С., Кайхан С.К., Токат Ф., Ачикел Эльмас М., Бирдоган С., Арбак С., Ялчин К. , Sezgin A, Kızılkılıç E, Hemşinlioğlu C, İnce Ü, Ratip S, Ovalı E. Доклиническая оценка эффективности и анализа безопасности CAR-T-клеток (ISIKOK-19), нацеленных на CD19-экспрессирующие B-клетки, для первого академического клинического исследования в Турции у пациентов с рецидивирующим/рефрактерным ОЛЛ и НХЛ. Терк Дж. Гематол. 2020; 37 : 234–247. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
7. Ран Т., Эйхмюллер С.Б., Шмидт П., Шландер М. Стоимость децентрализованного производства Т-клеток CAR в академической некоммерческой среде. Инт Джей Рак. 2020; 147 :3438–3445. [ PubMed ] [ Академия Google ]
8. Брудно Дж. Н., Сомервилл Р. П., Ши В., Роуз Дж. Дж., Халверсон Д. С., Фаулер Д. Х., Геа-Банаклош Дж. К., Павлетич С. З., Хикштейн Д. Д., Лу Т. Л., Фельдман С. А., Ивамото А. Т., Курландер Р., Марич И., Гой А., Хансен Б.Г., Уайлдер Дж.С., Блэклок-Шувер Б., Хаким Ф.Т., Розенберг С.А., Гресс Р.Е., Кохендерфер Дж.Н. Аллогенные Т-клетки, которые экспрессируют химерный антигенный рецептор анти-CD19, вызывают ремиссию В-клеточных злокачественных новообразований, которые прогрессируют после аллогенной трансплантации гемопоэтических стволовых клеток, не вызывая реакции «трансплантат против хозяина». Дж. Клин Онкол. 2016; 34 :1112–1121. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
9. Пак Дж. Х., Ривьер И., Гонен М., Ван Х., Сенешаль Б., Карран К.Дж., Сотер С., Ван Ю., Сантомассо Б., Мид Э., Рошал М., Маслак П., Давила М., Брентдженс Р.Дж., Садлен М. Долгосрочные последующее наблюдение терапии CD19 CAR при остром лимфобластном лейкозе. N Engl J Med. 2018; 378 : 449–459. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
10. Nastoupil LJ, Jain MD, Spiegel JY, Ghobadi A, Lin Y, Dahiya S, Lunning MA, Lekakis LJ, Reagan PM, Oluwole OO, McGuirk JP, Deol A, Sehgal AR, Goy A, Hill BT, Andreadis C, Муньос Дж., Вестин Дж. Р., Чавес Дж. К., Кашен А. Ф., Беннани Н. Н., Рапопорт А. П., Восе Дж. М., Миклош Д. Б., Нилапу С. С., Локк Ф. Л. Axicabtagene ciloleucel (Axi-Cel) CD19 химерный антигенный рецептор (CAR) Т-клеточная терапия рецидивирующей/рефрактерной крупноклеточной В-клеточной лимфомы: реальный мировой опыт. Кровь. 2018; 132 (Приложение 1) : 91. [ Академия Google ]
11. Lee DW, Kochenderfer JN, Stetler-Stevenson M, Cui YK, Delbrook C, Feldman SA, Fry TJ, Orentas R, Sabatino M, Shah NN, Steinberg SM, Stroncek D, Tschernia N, Yuan C, Zhang H, Zhang Л., Розенберг С.А., Уэйн А.С., Макколл К.Л. Т-клетки, экспрессирующие химерные антигенные рецепторы CD19, при остром лимфобластном лейкозе у детей и молодых людей: исследование фазы 1 с повышением дозы. Ланцет. 2015 г.; 385 : 517–528. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
12. Фрей Н.В., Шоу П.А., Хекснер Э.О., Пикиньо Э., Гилл С., Люгер С.М., Манган Дж.К., Лорен А.В., Перл А.Е., Мод С.Л., Групп С.А., Шах Н.Н., Гилмор Дж., Лейси С.Ф., Меленхорст Дж.Дж., Левин Б.Л., Июнь CH, Портер DL. Оптимизация Т-клеточной терапии химерными антигенными рецепторами у взрослых с острым лимфобластным лейкозом. Дж. Клин Онкол. 2020; 38 :415–422. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
13. Верчеллино Л., Ди Блази Р., Канун С., Тессулин Б., Росси К., Д'Авени-Пини М., Оберик Л., Боде-Милин С., Бориес П., Оливье П., Лафон И., Берриоло-Ридингер А., Галли Э., Bernard S, Rubio MT, Bossard C, Meignin V, Merlet P, Feugier P, Le Gouill S, Ysebaert L, Casasnovas O, Meignan M, Chevret S, Thieblemont C. Прогностические факторы раннего прогрессирования после терапии CAR Т-клетками при рецидиве /Рефрактерная диффузная крупноклеточная В-клеточная лимфома. Кровь Adv. 2020; 4 : 5607–5615. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
